
成本500萬(wàn),一致性評(píng)價(jià)做 or 不做?這些因素都應(yīng)納入考量
發(fā)布時(shí)間:2016-09-21 來(lái)源:佚名
從9月12日CFDI提供的企業(yè)參比試劑備案可以看出,截至2016年6月30日,共942個(gè)廠家產(chǎn)品參與了備案,其中508個(gè)廠家產(chǎn)品在289個(gè)仿制藥目錄內(nèi)。
無(wú)論是國(guó)家目前所要求的第一期仿制藥目錄內(nèi)產(chǎn)品,還是國(guó)家未要求開(kāi)始啟動(dòng)一致性評(píng)價(jià)但在國(guó)內(nèi)已上市的產(chǎn)品,對(duì)于是否啟動(dòng)一致性評(píng)價(jià),需要考慮的是該產(chǎn)品的未來(lái)競(jìng)爭(zhēng)態(tài)勢(shì)。
政策方向
質(zhì)量提升激勵(lì):關(guān)注2018年后政策
一致性評(píng)價(jià)的推動(dòng)源自2012年國(guó)務(wù)院關(guān)于印發(fā)國(guó)家藥品安全“十二五”規(guī)劃的通知。為了全面提升仿制藥質(zhì)量,當(dāng)時(shí)設(shè)定的目標(biāo)是:2007年修訂的《藥品注冊(cè)管理辦法》施行前批準(zhǔn)的仿制藥,屬于國(guó)家基本藥物目錄、臨床常用的在2015年前完成與被仿制藥進(jìn)行質(zhì)量一致性評(píng)價(jià),其余的分期分批完成,未通過(guò)質(zhì)量一致性評(píng)價(jià)的不予再注冊(cè)。
此項(xiàng)原是由政府部門推動(dòng)的項(xiàng)目,“十三五”時(shí)則改為企業(yè)全力承擔(dān)一致性評(píng)價(jià)的研究職責(zé)。第一期項(xiàng)目縮減到以國(guó)家基本藥物口服制劑為主,完成時(shí)間從2015年推遲到2018年。
因此,對(duì)于是否啟動(dòng)一致性評(píng)價(jià),2018年后的醫(yī)藥市場(chǎng)準(zhǔn)入政策是評(píng)估競(jìng)爭(zhēng)態(tài)勢(shì)的關(guān)鍵因素。例如通過(guò)一致性評(píng)價(jià)之后,藥品價(jià)格是相應(yīng)放開(kāi),還是沿用目前的藥品價(jià)格?這也決定了生產(chǎn)廠家投入一致性評(píng)價(jià)的積極性。
國(guó)家推動(dòng)一致性評(píng)價(jià)的初心是全面提升我國(guó)仿制藥質(zhì)量,通過(guò)質(zhì)量一致性評(píng)價(jià)的藥品將獲得市場(chǎng)準(zhǔn)入方面的激勵(lì)——藥品質(zhì)量提升后,在招標(biāo)中有望獲得質(zhì)量層次單列的激勵(lì)。
從市場(chǎng)準(zhǔn)入的角度看,2016年《廣東省醫(yī)療機(jī)構(gòu)藥品交易暫行辦法》對(duì)仿制藥的規(guī)則值得關(guān)注。
與大多數(shù)省份一樣,廣東把通過(guò)質(zhì)量一致性評(píng)價(jià)的仿制藥作為較高質(zhì)量層次進(jìn)行單列激勵(lì)。
然而,從2016年9月9日江蘇省發(fā)布的《2015年江蘇省藥品集中采購(gòu)申報(bào)資質(zhì)審核情況的通知》看,暫無(wú)廠家產(chǎn)品通過(guò)質(zhì)量一致性評(píng)價(jià)。
出口藥激勵(lì):國(guó)家意愿推動(dòng)國(guó)際化
不過(guò),按此前CFDA公告,國(guó)內(nèi)藥品生產(chǎn)企業(yè)已在歐盟、美國(guó)和日本獲準(zhǔn)上市的仿制藥,可以國(guó)外注冊(cè)申報(bào)的相關(guān)資料為基礎(chǔ),按照化學(xué)藥品新注冊(cè)分類申報(bào)藥品上市,批準(zhǔn)上市后視同通過(guò)一致性評(píng)價(jià);在中國(guó)境內(nèi)用同一生產(chǎn)線生產(chǎn)上市并在歐盟、美國(guó)和日本獲準(zhǔn)上市的藥品,視同通過(guò)一致性評(píng)價(jià)。
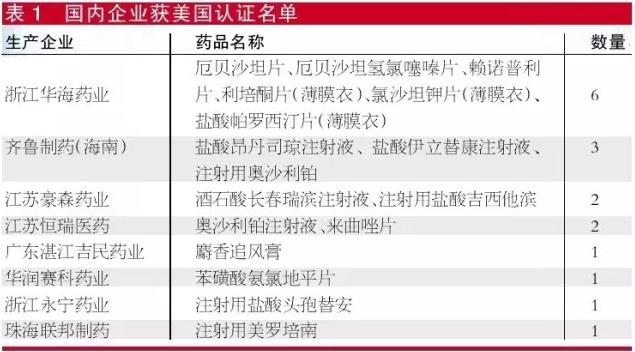
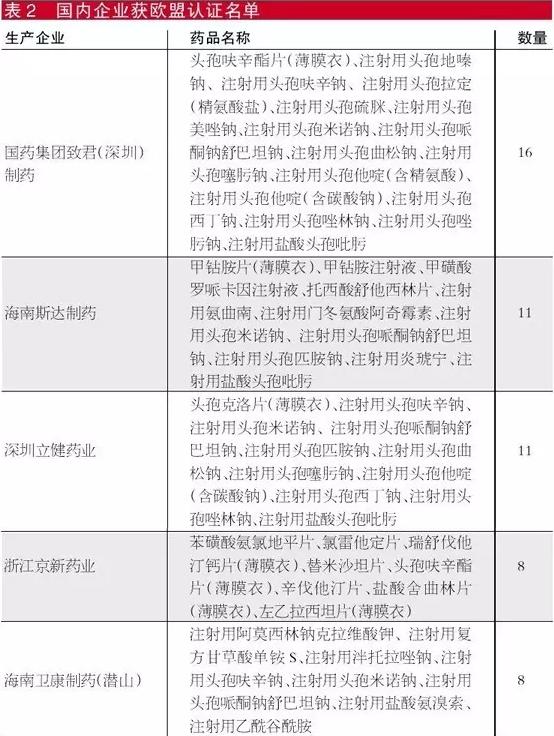
識(shí)敏信息分析江蘇公布的資質(zhì)名單后發(fā)現(xiàn),目前常用的28,654個(gè)醫(yī)院用藥名單中,國(guó)內(nèi)廠家有17個(gè)藥品通過(guò)美國(guó)認(rèn)證,85個(gè)藥品歐盟認(rèn)證,2個(gè)藥品通過(guò)日本認(rèn)證。

廣東藥品招標(biāo)政策還對(duì)出口藥激勵(lì)。在我國(guó)境內(nèi)生產(chǎn)的,獲美國(guó)FDA、歐盟cGMP(英國(guó)、法國(guó)、德國(guó))、加拿大、澳大利亞TGA、日本JGMP認(rèn)證,且具體品種劑型連續(xù)最近的3個(gè)會(huì)計(jì)年度在上述認(rèn)證國(guó)的出口總額按當(dāng)年匯率折算累計(jì)不低于1000萬(wàn)元人民幣(中成藥不低于500萬(wàn)元)的藥物制劑(不包括原料藥),也可作為較高質(zhì)量層次有望獲得單列。以上產(chǎn)品需同時(shí)具備認(rèn)證證書(shū)、認(rèn)證國(guó)進(jìn)口批文、海關(guān)出口退稅證明等材料作為認(rèn)定依據(jù)。
筆者根據(jù)江蘇日前公布的數(shù)據(jù)統(tǒng)計(jì)發(fā)現(xiàn),出口日本的國(guó)內(nèi)企業(yè)沒(méi)有任何一家達(dá)標(biāo),出口歐盟的有國(guó)藥集團(tuán)致君(深圳)制藥有限公司、華瑞制藥有限公司和深圳立健藥業(yè)有限公司,出口美國(guó)的達(dá)標(biāo)企業(yè)有江蘇恒瑞醫(yī)藥股份有限公司和浙江華海藥業(yè)股份有限公司。
過(guò)期專利藥企業(yè)授權(quán)或許可聯(lián)合生產(chǎn)的相應(yīng)藥品(授權(quán)人對(duì)原廠原料、生產(chǎn)工藝、質(zhì)量標(biāo)準(zhǔn)及質(zhì)量一致認(rèn)可的協(xié)議與證明)同樣屬于較高層次。這種對(duì)過(guò)期專利藥的授權(quán)生產(chǎn)激勵(lì)是全國(guó)首創(chuàng),這將利好如2012年與輝瑞簽訂了鹽酸克林霉素系列有關(guān)產(chǎn)品的生產(chǎn)技術(shù)和工藝授權(quán)合作協(xié)議的海翔藥業(yè)。
綜上所述,國(guó)家對(duì)于已經(jīng)“走出去”的藥品制劑獎(jiǎng)勵(lì)豐厚,同樣地,對(duì)于獲得國(guó)外技術(shù)提升產(chǎn)品質(zhì)量的廠家也有激勵(lì)政策。這再一次證明了國(guó)家正在推動(dòng)國(guó)內(nèi)生產(chǎn)企業(yè)通過(guò)產(chǎn)能升級(jí)往全球化發(fā)展。
企業(yè)應(yīng)對(duì)
建立平臺(tái)公司:成本預(yù)算!
分析2016年8月醫(yī)藥行業(yè)上市企業(yè)公布獲得臨床批件的公告數(shù)據(jù)發(fā)現(xiàn),共有32個(gè)項(xiàng)目標(biāo)記臨床批件獲得前原料和制劑的投入情況,其中僅有10%的項(xiàng)目投入費(fèi)用低于100萬(wàn)元,20%的項(xiàng)目投入費(fèi)用在100萬(wàn)~200萬(wàn)元之間,其余項(xiàng)目都在200萬(wàn)元以上。據(jù)此推算一致性評(píng)價(jià)的項(xiàng)目,500萬(wàn)元的項(xiàng)目費(fèi)在行業(yè)算是平均水平價(jià)。
而目前只有北京出臺(tái)文件鼓勵(lì)企業(yè)開(kāi)展一致性評(píng)價(jià),開(kāi)展體外一致性評(píng)價(jià)研究的品種擬支持科技經(jīng)費(fèi)100萬(wàn)~200萬(wàn)元,開(kāi)展BE試驗(yàn)的品種擬支持科技經(jīng)費(fèi)200萬(wàn)~300萬(wàn)元。
據(jù)悉,現(xiàn)有的行情是:一致性評(píng)價(jià)為原輔料采購(gòu)50萬(wàn)元,結(jié)構(gòu)確證和驗(yàn)證10萬(wàn)元左右(晶型、雜質(zhì)、粒度,雜質(zhì)還需要根據(jù)需要研究的數(shù)量遞增),工藝驗(yàn)證、動(dòng)態(tài)生產(chǎn)、小中試生產(chǎn)10萬(wàn)~20萬(wàn)元,注冊(cè)及檢驗(yàn)費(fèi)25萬(wàn)元,預(yù)試驗(yàn)50萬(wàn)~100萬(wàn)元,人力成本100萬(wàn)元,BE試驗(yàn)250萬(wàn)元。所有這些合計(jì)下來(lái),至少需要500萬(wàn)元。
截至2016年9月9日,2016年共有2家上市公司發(fā)布投資設(shè)立一致性評(píng)價(jià)平臺(tái)公司的公告,分別是湖南方盛制藥股份有限公司和深圳市海王生物工程股份有限公司,投資金額分別是2000萬(wàn)元和1億元。此類一致性評(píng)價(jià)平臺(tái)項(xiàng)目體現(xiàn)了生產(chǎn)企業(yè)應(yīng)對(duì)一致性評(píng)價(jià)政策而選擇往研發(fā)上游延伸。
但是,以一個(gè)項(xiàng)目至少500萬(wàn)元來(lái)計(jì)算,不計(jì)算固定資產(chǎn)的投入(海王的1億元項(xiàng)目對(duì)應(yīng)的固定資產(chǎn)產(chǎn)凈值就為1118.6萬(wàn)元),忽略人力成本,2000萬(wàn)元最多也只能做4個(gè)產(chǎn)品的項(xiàng)目。若一致性評(píng)價(jià)平臺(tái)想同時(shí)上幾十個(gè)項(xiàng)目,則需要投入較多運(yùn)作資金。
做OR不做?全面評(píng)估競(jìng)爭(zhēng)態(tài)勢(shì)
目前大部分企業(yè)都已對(duì)自己企業(yè)的產(chǎn)品梳理過(guò)一輪,并且已經(jīng)確定了擬進(jìn)行一致性評(píng)價(jià)的藥品清單;有些企業(yè)還完成了對(duì)CRO企業(yè)的招標(biāo),正式啟動(dòng)一致性評(píng)價(jià)。
根據(jù)CFDA的最新統(tǒng)計(jì),截至2016年5月31日,2018年之前須完成一致性評(píng)價(jià)的品種有289個(gè),對(duì)應(yīng)批文號(hào)17,740個(gè)。對(duì)于這些批文而言,此時(shí)再不啟動(dòng)基本就和放棄無(wú)異了。
擁有大批需要過(guò)一致性評(píng)價(jià)的生產(chǎn)批文的企業(yè)往往有國(guó)企背景,而國(guó)企對(duì)于是否放棄藥品批準(zhǔn)文號(hào)慎之又慎。
藥品批準(zhǔn)文號(hào)系國(guó)家藥監(jiān)部門準(zhǔn)許企業(yè)生產(chǎn)的合法標(biāo)志,該批準(zhǔn)文號(hào)受行政許可法的調(diào)整,本身不具有財(cái)產(chǎn)價(jià)值。但是,藥品批準(zhǔn)文號(hào)承載了一個(gè)藥品的生產(chǎn)工藝、質(zhì)量標(biāo)準(zhǔn)、品牌文化、銷售渠道覆蓋能力等內(nèi)容,在技術(shù)轉(zhuǎn)移中是具備交換價(jià)值的,于是就擁有交易價(jià)格。
對(duì)于國(guó)企而言,放棄藥品批準(zhǔn)文號(hào),有可能意味著國(guó)有資產(chǎn)的流失。因此,有的國(guó)企認(rèn)為,唯有其藥品在一致性評(píng)價(jià)最終不能獲得通過(guò),證實(shí)其所擁有的生產(chǎn)工藝、質(zhì)量標(biāo)準(zhǔn)等不具備價(jià)值,才可能放棄藥品批準(zhǔn)文號(hào)。但這可能與國(guó)家希望企業(yè)保護(hù)優(yōu)勢(shì)產(chǎn)品淘汰落后產(chǎn)能的供給側(cè)改革相悖。
17,740個(gè)藥品批文號(hào)乘以500萬(wàn)元的項(xiàng)目均價(jià),可大致推算出一致性評(píng)價(jià)的第三方市場(chǎng)潛力近千億元。
值得考慮的是,如果一個(gè)產(chǎn)品的年全國(guó)銷售額不到500萬(wàn)元,并且價(jià)格又不放開(kāi),那么需要10年才能回本,會(huì)有企業(yè)愿意投入這樣的項(xiàng)目嗎?17,740個(gè)基藥口服品種大部分是年銷售額過(guò)不了500萬(wàn)元的產(chǎn)品。
雖然我國(guó)藥品市場(chǎng)規(guī)模已過(guò)萬(wàn)億元,但投入一致性評(píng)價(jià)項(xiàng)目的錢始終是來(lái)自生產(chǎn)企業(yè)的利潤(rùn),我國(guó)藥品市場(chǎng)同質(zhì)化嚴(yán)重,利潤(rùn)率較低,實(shí)際上沒(méi)有多少企業(yè)能拿那么多錢去保品種,要保預(yù)計(jì)也是保利潤(rùn)率較高的在銷化學(xué)藥產(chǎn)品。
此外,評(píng)估一致性評(píng)價(jià)項(xiàng)目的未來(lái)競(jìng)爭(zhēng)態(tài)勢(shì),除了要研究國(guó)內(nèi)生產(chǎn)廠家的生產(chǎn)能力及注冊(cè)申報(bào)的成功率之外,也要研究美國(guó)和歐洲等地已上市產(chǎn)品的競(jìng)爭(zhēng)態(tài)勢(shì),國(guó)內(nèi)藥品市場(chǎng)規(guī)模和項(xiàng)目的利潤(rùn)回報(bào)將推動(dòng)進(jìn)口仿制藥進(jìn)入我國(guó)藥品市場(chǎng)。
對(duì)于批文負(fù)擔(dān)不太重的私企而言,需要完成一致性評(píng)價(jià)的項(xiàng)目較少,資金壓力相對(duì)也沒(méi)那么重。此類企業(yè)可以充分考慮目前國(guó)內(nèi)外項(xiàng)目整體投入費(fèi)用,并評(píng)估國(guó)內(nèi)藥品市場(chǎng)潛力,選擇價(jià)格相對(duì)較低但技術(shù)質(zhì)量相對(duì)較好的海外項(xiàng)目。





