CFDA:首仿優(yōu)先審批!利好這14藥企22個品種
發(fā)布時間:2016-07-25 來源:佚名
近日,CDE給了藥企一個利好。
7月21日,國家局藥品審評中心出臺了一極為簡練的《“首仿”品種實行優(yōu)先審評評定的基本原則》。原則總計249字。從發(fā)布意義上而言,該文件更像部門工作計劃調(diào)整的告知函。CDE在該文件從藥品申報上提出了部門內(nèi)部的“首仿藥”的定義,并將首仿藥的申報注冊納入優(yōu)先范疇。這將大大提速首仿藥物的上市進程。
首仿藥需同時滿足以下條件:
(一) 同品種僅有一家進口上市;
(二) 待審評同品種中,按藥品審評中心承辦日期先后順序屬于第一家的;
(三) 已經(jīng)超出法定審評期限。
首仿藥以前無官方定義
“首仿”概念源于美國首仿藥的概念,《藥品價格競爭和專利期恢復法》(Hatch-Waxman修正案)規(guī)定,在“專利無效或者批準正在申請的藥物不會侵犯專利”的情況下,第一個仿制申請者將擁有180天的市場專賣權,在此期間,F(xiàn)DA不再批準相同的ANDA(新藥上市申請)。
“首仿藥物”在我國優(yōu)待地位并不明顯,根據(jù)2016年3月國家局發(fā)布的《化學藥品注冊分類改革工作方案》,首仿藥物并不存在以上保護期。“首仿藥物”價值更多體現(xiàn)藥品招標中,在雙信封制度的技術評分的加分。
2005年發(fā)改委在《藥品價格管理辦法》中提出了首仿概念,定義為國內(nèi)首先仿制生產(chǎn)并上市銷售的藥物。在2006年國家發(fā)改委發(fā)布的《藥品定價辦法》(征求意見稿)一文中,官方提出單獨定價藥品的概念,指出“符合下列條件之一的同種仿制類藥品,經(jīng)專家論證后,允許在統(tǒng)一定價基礎上適當上浮價格:……國內(nèi)首先仿制生產(chǎn)并上市銷售的”。根據(jù)物價部門組織的單獨定價認定流程,由專家論證確定企業(yè)所申報的產(chǎn)品是否為首仿藥,從而獲得單獨定價資格。
而后續(xù)一些省份招標文件中,將“首仿藥物”、“單獨定價藥物”列為較高質量層次,實行單獨競價組,或進行一定的溢價處理。
由于部門間數(shù)據(jù)未有效對接,且首仿藥的定義在各省招標文件的更新,內(nèi)涵不斷延伸,是否為首仿藥在我國沒有一個官方的界定標準。該資格認定主要以各省招標辦根據(jù)企業(yè)主張及提交的材料審核,在文件公示無質疑后定義為首仿藥物。
但各省招標規(guī)則認定的首仿藥物,普遍要求:首家仿照國外專利技術生產(chǎn)的藥品,以國家食品藥品監(jiān)督管理局批準文號批準時間,結合質量標準起草證明為依據(jù),同時持有新藥證書的國產(chǎn)藥品等。
首仿藥規(guī)則寬泛,利好
而本次CDE公布的“首仿藥物”優(yōu)先評審清單,所列出產(chǎn)品主要為6類注冊(即國內(nèi)已有上市藥品的仿制),遠較原來各省規(guī)則寬泛。
從招標的角度而言,如果一家進口和一家國內(nèi)首仿廠家同時共存,進口廠家以過期原研單列,國內(nèi)廠家質量層次分組中屬于獨家,此時國內(nèi)廠家更希望通過注冊法規(guī)獲得更長的獨占期而非招標意義上的"首仿"。
唯有同產(chǎn)品多家的"首家"廠家更希望從獲批時間差中獲得價格優(yōu)勢和中標分組單一貨源供應。隨著一致性評價的法規(guī)的推進,藥品招標的質量分層更加關注的是否通過一致性評價。
結語:首仿由CDE認定,招標利好
CDE對首仿藥的定義中有一個重要的條件是:已經(jīng)超出法定審評期限。這個定義表明只有超過注冊時間的才能補償待遇,這意味如果申報正常按時獲批的首仿藥物并沒有加快。因此這個今天引起了較多規(guī)則的藥品注冊政策,可能只是短期政策。而對一些有多家企業(yè)生產(chǎn)的藥品而言,在藥品招標的資質認定中,也許能通過CDE的這個定義獲得一些招標優(yōu)勢。
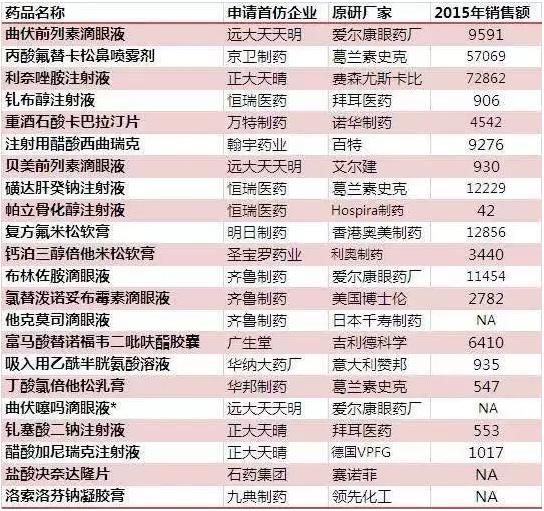
附:首仿藥優(yōu)先審評名單及2015年市場銷售規(guī)模(萬元)