
隨著新藥上市 乳腺癌用藥市場將如何變化?
發(fā)布時間:2016-11-29 來源:佚名
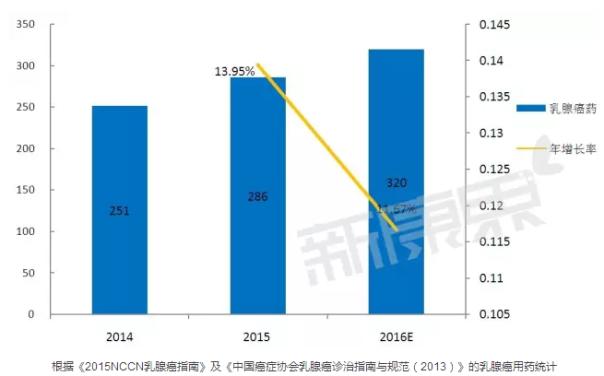
乳腺癌作為危害我國女性健康的重大疾病之一,其死亡率居女性惡性腫瘤發(fā)病率首位。據(jù)中康CMH所監(jiān)測數(shù)據(jù)的統(tǒng)計,2015年國內(nèi)乳腺癌用藥總體規(guī)模286億元,比2014年增長了了13.95%。2016年預(yù)計規(guī)模將達到320億元,增速預(yù)計為11.67%。這個增速亮眼的賽場中,誰家跑在前面?而在新選手進入后,賽場格局又將如何變化?
近年來,乳腺癌已成為全球女性發(fā)病率最高的一種癌癥,嚴重危害了女性的身心健康。國際癌癥研究機構(gòu)Globocan 2012年統(tǒng)計數(shù)據(jù)顯示,全世界每年有超過167萬女性罹患乳腺癌,其中52.9%發(fā)生在發(fā)展中國家。另外,我國國家癌癥中心2015年統(tǒng)計數(shù)據(jù)顯示,全國新發(fā)乳腺癌病例數(shù)達27.24萬,每年死亡率超過7萬,居女性惡性腫瘤發(fā)病率首位。
但是,乳腺癌的發(fā)病機制至今尚未完全明確。傳統(tǒng)而言,乳腺癌分為:HER2-陽性乳腺癌、激素受體陽性(HR+)乳腺癌和三陰乳腺癌(TNBC)(雌激素受體、孕激素受體、HER2均未過度表達)。其中,HER2陽性乳腺癌最為兇險,約占20-30% ,對另外兩種類型的乳腺癌而言,HER2陽性乳腺癌的惡化速度更快,惡化程度更嚴重,且更容易復(fù)發(fā)和轉(zhuǎn)移。
《2015NCCN乳腺癌指南》及《中國癌癥協(xié)會乳腺癌診治指南與規(guī)范(2013)》指出,乳腺癌的藥物治療分為靶向藥物治療、化療和內(nèi)分泌治療。
目前,市場上絕大部分乳腺癌藥物是屬于陽性乳腺癌治療藥物。據(jù)IMS數(shù)據(jù),全球乳腺癌治療藥物市場規(guī)模于2014年高達112.7億美元,三大制藥巨頭(羅氏、諾華和阿斯利康)占據(jù)了乳腺癌藥物市場的霸主地位。
國際用藥市場格局
在乳腺癌用藥市場中,羅氏研發(fā)的曲妥珠單抗(Trastuzumab)雄踞榜首,領(lǐng)跑整個市場。據(jù)羅氏年度報表顯示,其2014年全球總銷售額高達45億美元。2014年,全球乳腺癌TOP5產(chǎn)品分別是曲妥珠單抗、依維莫司、帕妥珠單抗、氟維司群、貝伐珠單抗。(根據(jù)各公司報表數(shù)據(jù)排名)。
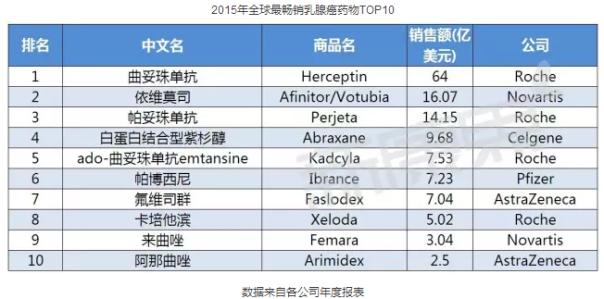
曲妥珠單抗、依維莫司、帕妥珠單抗繼續(xù)蟬聯(lián)前三甲,在前十產(chǎn)品中,羅氏占據(jù)了四個席位,稱霸全球乳腺癌用藥市場。
縱觀全球乳腺癌藥物市場方陣后,再來橫看國內(nèi)市場格局。中康CMH對全國乳腺癌用藥市場作掃描,旨在追蹤乳腺癌藥物的市場表現(xiàn),以及哪些產(chǎn)品在國內(nèi)市場中最受青睞。
國內(nèi)用藥市場格局
據(jù)中康CMH所監(jiān)測數(shù)據(jù)的統(tǒng)計,2015年國內(nèi)乳腺癌用藥總體規(guī)模286億元,比2014年增長了了13.95%。2016年預(yù)計規(guī)模將達到320億元,增速預(yù)計為11.67%。
國內(nèi)市場規(guī)模不是非常大,其原因可能有:
1、國內(nèi)女性缺乏對早期發(fā)現(xiàn)疾病的認識,并且國內(nèi)衛(wèi)生服務(wù)方面尚不完善,多數(shù)患有乳腺癌的女性在疾病晚期才得到診斷;
2、乳腺癌用藥費用較高,國內(nèi)大部分患者難以承擔,只能放棄治療;
3、有些國外研發(fā)的新藥還未在國內(nèi)上市。
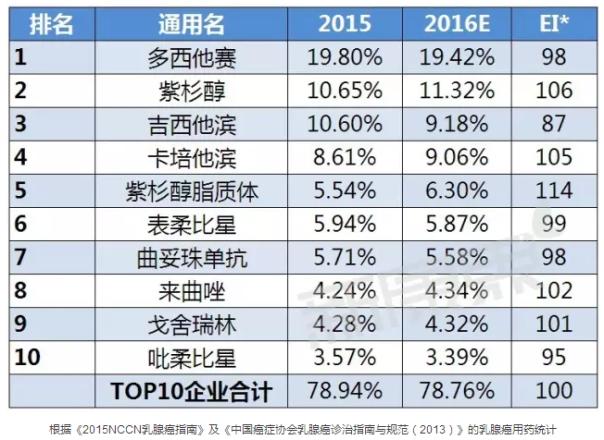
國內(nèi)TOP10產(chǎn)品
據(jù)中康CMH監(jiān)測數(shù)據(jù)顯示,2015年乳腺癌用藥前十通用名的規(guī)模為225.94億元,較2014年的市場規(guī)模上升了14.53%,而且前十通用名占了78.94%的市場份額,市場集中度較高;其中多西他賽以19.80%的市場份額位列第一。而2014年以39.93%市場份額雄踞全球榜首的曲妥珠單抗在國內(nèi)市場表現(xiàn)并不佳,只有5.71%的市場份額。依各通用名產(chǎn)品市場份額變化趨勢來看,預(yù)計2016年乳腺癌用藥TOP10產(chǎn)品中有一半呈增長趨勢,其中增長勢頭最猛的可能是紫杉醇脂質(zhì)體,預(yù)計多西他賽將繼續(xù)保持第一的名次。
國內(nèi)TOP10品牌
據(jù)中康CMH監(jiān)測數(shù)據(jù)顯示,2015年乳腺癌用藥前十品牌的規(guī)模為148.81億元,增長了12.67%,TOP10品牌市場份額占五成;其中羅氏制藥的卡培他濱片以8.61%的市場份額位列第一。從各品牌市場份額的變化趨勢來看,預(yù)計2016年乳腺癌用藥TOP10品牌的增長趨勢不明顯,且有一半的品牌有下降趨勢。
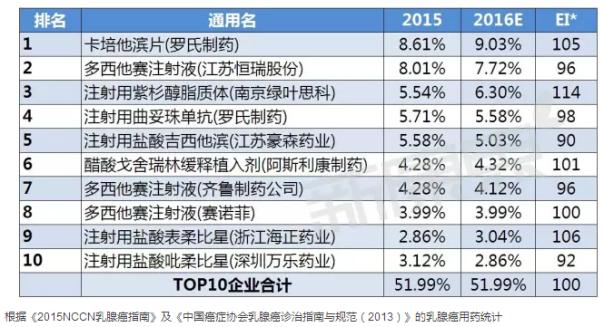
國內(nèi)TOP10企業(yè)
據(jù)中康CMH監(jiān)測數(shù)據(jù)顯示,2015年乳腺癌用藥前十企業(yè)的規(guī)模為200.19億元,占據(jù)七成的市場份額,市場集中度較高。外資企業(yè)有四家公司入圍國內(nèi)市場的前十,國內(nèi)企業(yè)略有優(yōu)勢,說明國內(nèi)企業(yè)在乳腺癌市場表現(xiàn)出有力競爭力;其中羅氏制藥以15.66%的市場份額雄踞國內(nèi)乳腺癌用藥市場榜首;恒瑞作為國內(nèi)創(chuàng)新藥領(lǐng)頭羊企業(yè),其以10.49%的份額位列第二。從各企業(yè)市場份額的變化趨勢來看,預(yù)計2016年乳腺癌用藥TOP10企業(yè)中一半的企業(yè)表現(xiàn)出不同程度的下降趨勢,而羅氏略有有增長,將繼續(xù)維持其霸主地位。
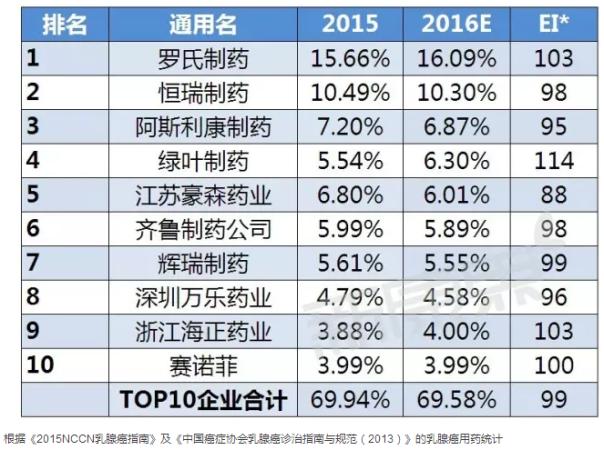
乳腺癌用藥市場增長放緩,乳腺癌用藥品牌增長不明顯,這可能跟國內(nèi)經(jīng)濟增長放緩,及各類醫(yī)改、藥改政策(招標降價、藥占比限制、二次議價、兩票制乃至一票制、能否進醫(yī)保藥品目錄等)的連續(xù)發(fā)布相關(guān),引起各企業(yè)在乳腺癌用藥市場的競爭越來越激烈。
市場格局將如何變化?
輝瑞研發(fā)的帕博西尼(palbociclib)于2015年2月獲FDA批準上市,是全球上市的首個CDK4/6抑制劑,用于HR+/HER2-晚期或轉(zhuǎn)移性乳腺癌女性患者的一線治療,輝瑞2015—2016的季報顯示,Palbociclib在上市第一年全球銷售額就高達7.23億美元,2016年第一、二季度的銷售額達到9.43億美元。同時,2016年2月,F(xiàn)DA進一步批準帕博替尼用于接受內(nèi)分泌治療后病情進展的HR+/HER2-晚期或轉(zhuǎn)移性乳腺癌的二線治療。但該藥還未在國內(nèi)上市,若其在國內(nèi)上市后,一方面可擴大市場容量,另一方面也對國內(nèi)的傳統(tǒng)乳腺癌用藥產(chǎn)生競爭壓力。截至今年11月3日,于藥品審評中心申報Palbociclib的廠家,有輝瑞及15家中國藥企。輝瑞的申報已于2014年7月獲批臨床,國內(nèi)有8家企業(yè)獲得臨床批件。
另外,近日,諾華制藥所研發(fā)的新型口服靶向抗癌藥CDK4/6抑制劑LEE011(ribociclib)在美國FDA和歐盟監(jiān)管方面獲得了重大進展,是乳腺癌藥物界的一重大喜訊。美國方面,美國FDA已正式受理LEE011的新藥申請(NDA)并授予優(yōu)先審查資格。歐洲方面,歐洲藥品管理局(EMA)正式受理了LEE011的上市許可申請(MAA)。諾華此次進行的NDA和MAA,目的是尋求批準LEE011聯(lián)合來曲唑用于激素受體陽性(HR+)/ HER2-陰性晚期或轉(zhuǎn)移性乳腺癌的一線治療。若該藥獲批,將是輝瑞在該領(lǐng)域?qū)妱鸥偁帉κ帧脮r,市場將如何變化,值得期待。
此外,衛(wèi)材研發(fā)的單用化療新型抗癌藥Halaven(eribulin mesylate,甲磺酸艾瑞布林)近日被英國國家衛(wèi)生與臨床優(yōu)化研究所(NICE)批準,用于已往接受過2種化療方案但病情進展的局部晚期或轉(zhuǎn)移性乳腺癌患者的常規(guī)治療。目前,該藥已獲全球約60多個國家批準。衛(wèi)材于2016年8月也向CFDA提交了Halaven治療局部晚期或轉(zhuǎn)移性乳腺癌的新藥申請(NDA)。
隨著乳腺癌新藥的上市,國際市場規(guī)模將進一步擴大,同時也會對老藥市場產(chǎn)生一定影響。
另外,從中康的檢測數(shù)據(jù)中可獲知,目前國內(nèi)乳腺癌藥物容量并不算大,市場還有待進一步的開發(fā),也說明國內(nèi)市場潛力強大,乳腺癌藥物市場可待搶占。
隨著乳腺癌進口藥品不斷在國內(nèi)進行新藥申請,這將會不斷擠壓國內(nèi)乳腺癌用藥市場。國內(nèi)企業(yè)是否能夠搶占國內(nèi)巨大的乳腺癌市場呢?
目前,國內(nèi)原研乳腺癌藥物進入臨床研究的有一共有6個,其中一個處于臨床三期,一個處于臨床二期,四個處于臨床一期,而國內(nèi)創(chuàng)新藥領(lǐng)頭企業(yè)恒瑞占據(jù)兩個席位,該企業(yè)自主研發(fā)的 SHR-6390(Ⅰ期)和馬來酸吡咯替尼(Ⅱ期)。這些進入臨床研究的國內(nèi)自主研發(fā)的新藥,一旦早于國外新藥先上市將搶占國內(nèi)乳腺癌市場。





